quimicatucurui2012
sábado, 9 de junho de 2012
O passado é um país estrangeiro
Este blog pretende ser espaço de trocas de
experiências com os interessados em refletir sobre História, Ensino de
História e Cultura. A frase acima é de HARTLEY apud ROWLAND, Robert
(1997). Participe do blog, faça seus comentários, opine. Se você não tem
blog, pode postar como "anônimo". As portas estão abertas! Sejam bem
vindos!!
Comei-vos uns aos outros!!! (Clécio Penedo)

Carlos Fausto indicou uma ironia da História: "o ‘amai-vos uns aos outros da cultura cristã acabara por devorar o ‘comei-vos uns aos outros’ da ética tupi”. Mas, em nome do amor, muitos conquistadores transformaram-se em “temíveis canibais do espírito”. Sejamos canibais de cultura, soluções, relações harmônicas com a natureza e com os homens, respeito à diversidade.
quarta-feira, 5 de janeiro de 2011
BELEZAS DO PARÁ: CACHOEIRAS EM ORIXIMINÁ
Da
última vez que estive na cidade de Oriximiná, Oeste do Pará, tive a
felicidade de conhecer duas cachoeiras, das muitas que a região têm. O
acesso é por estrada não pavimentada, que por si só já é uma aventura.
Curvas fechadas, poças de água, mata ora aberta nas fazendas, ora
fechada, gado no meio do caminho...

Foto: Márcio Couto Henrique, dez. 2010.
Para
quem vive em cidade como Belém, de paisagem plana, é um espetáculo ver
essas maravilhas da natureza! As fotos abaixo mostram a cachoeira que
fica numa propriedade particular, do Sr. Harada, mas que pode ser
visitada ou alugada pelo público.
Foto: Márcio Couto Henrique, dez. 2010.
Foto: Márcio Couto Henrique, dez. 2010.
Mas
existem também cachoeiras em espaço público, de livre acesso, como essa
que você pode ver abaixo, que é bem maior que a outra:
Foto: Márcio Couto Henrique, dez. 2010.
Infelizmente,
existem pessoas que não têm consciência do valor desses lugares e se
acham no direito de grifar seus nomes nas pedras que embelezam o lugar e
fazem parte do patrimônio natural da cidade, vejam abaixo:
Foto: Márcio Couto Henrique, dez. 2010.
Esse
tipo de experiência, a gente eterniza no coração, na memória, não
precisa ficar riscando o patrimônio natural! E não tem coisa mais
"mico", mais mal educada, mais nada a ver, do que ficar deixando seu
nome escrito nas paredes, nas carteiras, nas pedras... isso é
completamente feio, muito feio! Comportamento anti-patrimonial! As
pessoas podem se autoafirmar e deixar memória de si de outras formas na
vida, mais nobres.
Mas
o poder público municipal de Oriximiná também pode e deve contribuir
para a educação patrimonial de seus habitantes, com campanhas de
educação patrimonial constantes que despertem para o valor do patrimônio
natural local. Uma boa iniciativa, nesse sentido, seria a retirada do
lixão a céu aberto que fica logo na entrada da cidade, e que é uma das
primeiras imagens que o visitante tem da cidade, logo ao sair do
aeroporto, vendo a triste cena de homens, mulheres e crianças disputando
o lixo com os urubus (como se vê em muitas outras cidades do país):
Foto: Márcio Couto Henrique, dez. 2010.
Certamente que é melhor sair de Oriximiná com a imagem abaixo:
Foto: Márcio Couto Henrique, dez. 2010.
Um último comentário: às vezes
se viaja para tão longe, imaginando que só em lugares muito distantes de
nós existem maravilhas a serem vistas... Existem muitos lugares bonitos
no Brasil, no Pará (de onde falo), e muitas vezes nossos planos só
incluem lugares distantes, que às vezes nos mostram aquelas belezas
"plastificadas". A região Oeste do Pará têm muitas belezas, além de
Oriximiná. Santarém é um lugar lindo e foi preciso que alguém fora do
Brasil dissesse que Alter do Chão é uma das praias mais bonitas do mundo
para que muita gente pensasse em visitá-la!
Agradeço
aos oriximinaenses que me propiciaram e me acompanharam nesse delicioso
e inesquecível passeio: Sofia, Tino, Tamara, Ricardo, Bruno, Carol,
Lilica, Nonato, Elder e a "pestinha" do João Pedro.
Postado por
O passado é um país estrangeiro
domingo, 3 de junho de 2012
Emissão de Gases de Efeito Estufa no Brasil
Emissão
de Gases de Efeito Estufa no Brasil
Tabela com a emissão de gases poluentes do efeito estufa no Brasil
Tabela com a emissão de gases poluentes do efeito estufa no Brasil

Gases do efeito estufa: diretamente ligados ao aquecimento global
Tabela
de emissões de gases do Efeito Estufa no Brasil (ano de 1994)

Tabela extraída do site do Ministério do Meio Ambiente em 02/10/2009
Observações:
1
- GWP= Potencial de Aquecimento Global
2
- Foram levados em consideração apenas a família de gases poluentes do Efeito
Estufa definidos no Protocolo de Kioto.
3
- Gg (unidade de medida Gigagrama). 1 Gg equivale a 10³
toneladas do gás poluente.
Gases Poluentes
Gases Poluentes
Saiba o que são, definição da palavra e links relacionados
Saiba o que são, definição da palavra e links relacionados

Emissão de gases na atmosfera
Definição
Os gases poluentes são aqueles produzidos, principalmente, pela queima de: combustíveis fósseis (gasolina e óleo diesel), resíduos orgânicos (lixos) e vegetação florestal. Estes gases absorvem parte da radiação infra-vermelha emitida pela Terra, favorecendo e efeito estufa e o aquecimento global.
Os gases poluentes são aqueles produzidos, principalmente, pela queima de: combustíveis fósseis (gasolina e óleo diesel), resíduos orgânicos (lixos) e vegetação florestal. Estes gases absorvem parte da radiação infra-vermelha emitida pela Terra, favorecendo e efeito estufa e o aquecimento global.
Os principais gases poluentes da
atmosfera são: dióxido de carbono, gás metano, perfluorcarbonetos,
óxido nitroso e hidrofluorcarbonetos.

Gases do Efeito Estufa
Gases
do Efeito Estufa
Os gases que geram o efeito estufa, principais gases, atividades geradoras de gases do Efeito Estufa, aquecimento global
Os gases que geram o efeito estufa, principais gases, atividades geradoras de gases do Efeito Estufa, aquecimento global

Gases do efeito estufa: principais responsáveis pelo aquecimento global
O
que são
Os
gases do efeito estufa são aqueles que dificultam ou impedem a dispersão para
o espaço da radiação solar que é refletida pela Terra. Grande parte destes
gases é produzida pelos seres humanos em diversas atividades, principalmente
pela queima de combustíveis fósseis, atividades industriais e queimadas de
florestas. Ao segurar este calor em nosso planeta, estes gases estão também
provocando o aquecimento global.
Principais
gases do Efeito Estufa
-
Dióxido de Carbono - CO2
-
Gás Metano - CH4
-
Óxido Nitroso - N2O
-
Perfluorcarbonetos
-
Hexafluoreto de Enxofre - SF6
-
Hidrofluorcarbonetos - HFCs
Principais
atividades geradoras de Gases do Efeito Estufa - No Brasil
-
Uso de Florestas e Terras (61%)
-
Agricultura (19%)
-
Geração de energia (15%)
-
Atividades da indústria (3%)
-
Tratamento de resíduos (2%)
Fonte:
Ministério da Ciência e Tecnologia (ano base: 2005)
Principais
atividades geradoras de Gases do Efeito Estufa - No Mundo
-
Geração de Eletricidade e Calor (24,9%)
-
Indústria (14,7%)
-
Transporte (14,3%)
-
Agricultura (13,8%)
-
Mudanças no uso do solo (12,2%)
-
Outros combustíveis (8,6%)
-
Processos industriais (4,3%)
-
Lixo (3,2%)
-
Emissões de gases provenientes de equipamentos de pressão (4%)
Fonte:
World Resources Institute
sábado, 2 de junho de 2012
ISOMERIA
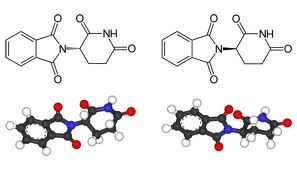
Comportamento de substâncias com mesma fórmula molecular.
O termo Isomeria vem do grego (iso = mesma(s); meros = partes). Partes iguais para transmitir a ideia de “mesma composição”.
A Isomeria é o fenômeno pelo qual duas substâncias compartilham a mesma fórmula molecular, mas apresentam estruturas diferentes, ou seja, o rearranjo dos átomos se difere em cada caso.
O fenômeno ocorre principalmente em compostos de carbono, considerando a variedade de substâncias orgânicas presentes na natureza. A tetravalência do carbono permite formar longas cadeias estáveis e com múltiplas combinações. Eis aí a questão-chave da Isomeria - o estudo das diferentes probabilidades de existência de compostos com mesma fórmula molecular.
Visite os artigos a seguir, interessando-se pelos diferentes tipos de Isomeria:
Isomeria Plana: conheça os isômeros através do estudo de suas fórmulas estruturais planas.
Isomeria Espacial: saiba tudo sobre Isomeria Geométrica (moléculas num plano imaginário) e isomeria óptica (isômeros que desviam o plano de vibração de luz polarizada).
E não perca a oportunidade de conhecer a história da Isomeria! Um breve esclarecimento de como tudo começou.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
A Isomeria é o fenômeno pelo qual duas substâncias compartilham a mesma fórmula molecular, mas apresentam estruturas diferentes, ou seja, o rearranjo dos átomos se difere em cada caso.
O fenômeno ocorre principalmente em compostos de carbono, considerando a variedade de substâncias orgânicas presentes na natureza. A tetravalência do carbono permite formar longas cadeias estáveis e com múltiplas combinações. Eis aí a questão-chave da Isomeria - o estudo das diferentes probabilidades de existência de compostos com mesma fórmula molecular.
Visite os artigos a seguir, interessando-se pelos diferentes tipos de Isomeria:
Isomeria Plana: conheça os isômeros através do estudo de suas fórmulas estruturais planas.
Isomeria Espacial: saiba tudo sobre Isomeria Geométrica (moléculas num plano imaginário) e isomeria óptica (isômeros que desviam o plano de vibração de luz polarizada).
E não perca a oportunidade de conhecer a história da Isomeria! Um breve esclarecimento de como tudo começou.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
LIGAÇÃO DE HIDROGENIO

Ligações de Hidrogênio existentes entre as moléculas de água
Conforme explanado no texto “Tipos
de Forças Intermoleculares”, as moléculas das substâncias nos três
estados físicos (sólido, líquido e gasoso) se atraem por meio de uma das
forças intermoleculares.
As três forças intermoleculares conhecidas são: dipolo induzido – dipolo induzido, dipolo permanente – dipolo permanente e ligação de hidrogênio.
Entre elas, a ligação de hidrogênio é a mais forte. Alguns autores
costumavam se referir a essa força intermolecular como pontes de
hidrogênio; porém, o termo correto e aceito pela IUPAC é “ligação de
hidrogênio”.
Esse tipo de interação
ocorre quando a molécula possui hidrogênio ligado a flúor, nitrogênio ou
oxigênio, que são átomos fortemente eletronegativos.
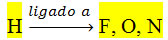
A ligação de hidrogênio é um exemplo extremo da ligação dipolo
permanente-dipolo permanente. Pois o hidrogênio de uma molécula
constitui um polo positivo, que se liga a um desses átomos de flúor,
oxigênio ou nitrogênio de outra molécula, que constituem o polo negativo
delas.
Normalmente, as ligações intermoleculares ocorrem com as substâncias
nos estados líquido e sólido. Além disso, visto que é uma força de
atração muito intensa, é necessária uma energia bem alta para rompê-la.
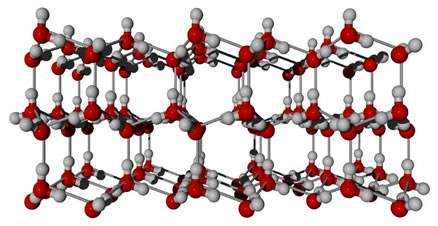
Uma substância que apresenta essa força intermolecular é a própria água. Observe como isso ocorre na ilustração abaixo:

Observe que cada molécula de água fica circundada espacialmente por
outras quatro moléculas de água, sendo que as ligações de hidrogênio
ocorrem pela ligação entre o hidrogênio de uma molécula (polo positivo)
com o oxigênio de outra (polo negativo).
As ligações de hidrogênio explicam vários fenômenos da natureza, veja os seguintes exemplos:
- O fato de o gelo flutuar na água: O gelo é menos denso do que a água e, consequentemente, flutua nela. Isso ocorre porque enquanto no estado líquido as ligações de hidrogênio que ocorrem entre as moléculas de água estão dispostas numa forma desorganizada, as ligações de hidrogênio nas moléculas do gelo são mais espaçadas e organizadas, formando uma estrutura rígida de forma hexagonal, que faz as moléculas ocupar um espaço bem maior do que ocupariam se estivessem no estado líquido.
É inclusive por isso que se colocarmos água no volume total de uma
garrafa e a colocarmos posteriormente em um refrigerador, seu volume se
expandirá e a garrafa irá rachar.
Assim, haverá a mesma quantidade de moléculas por unidade de volume, o
que diminui a densidade, segundo a fórmula da densidade: d = m/v. Haverá
espaços vazios entre os hexágonos formados, diminuindo a densidade
dessa substância.
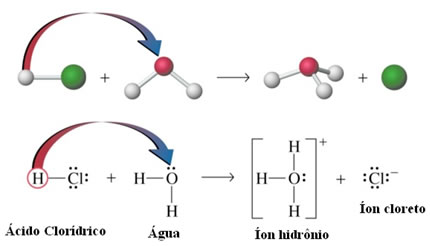
- Ionização dos ácidos: Apesar de as ligações de hidrogênio serem aproximadamente dez vezes mais fracas que as ligações covalentes; em determinadas circunstâncias elas conseguem romper as ligações covalentes. Por exemplo, no caso mostrado a seguir, o ácido clorídrico é dissolvido em água. O oxigênio da água atrai mais o hidrogênio ligado ao cloro do ácido do que o próprio cloro, dando origem aos íons hidrônio (H3O+) e cloreto (Cl-). Esse fenômeno é denominado de ionização:
- Tensão superficial da água: as moléculas que estão na superfície do líquido se atraem pelas ligações de hidrogênio somente com as moléculas ao seu lado e abaixo, pois não existem moléculas acima. Já as moléculas que estão abaixo da superfície realizam esse tipo de ligação com moléculas em todas as direções, o resultado é a formação de uma espécie de película ou fina camada na superfície da água, que a envolve.

Isso explica o fato de insetos poderem permanecer sobre ela e também o fenômeno da forma esférica das gotas de água.

Por Jennifer Fogaça
Graduada em Química
Assinar:
Postagens (Atom)











